باتری (battery)، مجموعهای از یک یا چند سلول است که با انجام واکنشهای شیمیایی، جریان الکترونها در درون مدار را ایجاد میکند. همه باتریها از سه جز اصلی تشکیل شدهاند: یک آنود (anode) یا همان قسمت منفی (-)، یک کاتد (cathode) یا همان قسمت مثبت (+) و نوعی الکترولیت (یک ماده شیمیایی که با آند و کاتد واکنش میدهد).
زمانی که آند و کاتد یک باتری به مدار متصل است، یک واکنش شیمیایی بین آند و الکترولیت اتفاق میافتد. این واکنش، باعث جریان الکترونها در درون مدار و برگشت آنها به کاتد شده و در آنجا (کاتد)، یک واکنش دیگر رخ میدهد. زمانی که مواد موجود در کاتد یا آند مصرف شده یا دیگر در واکنش قابل استفاده نباشد، باتری دیگر قادر به تولید الکتریسیته نخواهد بود. در آن حالت، باتری اصطلاحاً «مرده» است.
باتریهایی که بعد از استفاده دور انداخته میشوند، به عنوان «باتری اولیه» شناخته میشوند. به باتریهای قابل شارژ، «باتری ثانویه» میگویند.

باتریهای لیتیوم-پلیمری قابل شارژ
بدون وجود باتریها، مجبور بودید هلیکوپتر اسباببازی خود را روی دیوار آویزان کنید، برای روشن کردن ماشین خود با دست هندل بزنید و کنترل ایکسباکس (Xbox) خود را همیشه به کنسول وصل کنید (مثل روزهای خوش قدیم). باتریها، امکان ذخیرهسازی انرژی پتانسیل الکتریکی در یک محفظه قابلحمل را میدهند.

باتریهای، اشکال، اندازهها و ترکیبات شیمیایی مختلفی دارند
اختراع باتریهای جدید به آلساندرو ولتا (Alessandro Volta) منصوب است. ماجرای اختراع باتری به صورت اتفاقی و در حین کالبدشکافی قورباغه شروع شد.
موضوعاتی که شما در این پست و دو پست بعدی خواهید آموخت:
- نحوه اختراع باتری
- اجزای سازنده باتری
- نحوه کار باتری
- اصطلاحات رایج در توصیف باتری
- روشهای مختلف استفاده از باتری در یک مدار
تاریخچه
اصطلاح باتری
از نظر تاریخی، واژه «باتری» برای توصیف «مجموعهای از اشیا مشابه که برای انجام عملکرد خاصی در کنار هم قرار گرفتهاند»، مانند یک آتشبار (Artillery battery) استفاده شده است. در سال ۱۷۴۹ میلادی، بنجامین فرانکلین (Benjamin Franklin) برای اولین بار از این اصطلاح، به منظور توصیف یک سری خازن استفاده کرد که برای انجام آزمایشهای الکتریکی خود به هم متصل کرده بود. بعدها این اصطلاح، برای همه سلولهای الکتروشیمیایی استفاده شد که به منظور فراهم کردن نیروی الکتریکی به هم متصل شدهاند.
باتری خازنهای بطری لیدن (Leyden Jar) در اتصال با یکدیگر
اختراع باتری
در یک روز سرنوشتساز در سال ۱۷۸۰ میلادی، فیزیکدان، پزشک، زیستشناس و فیلسوف ایتالیایی، لوییجی گالوانی (Luigi Galvani)، در حال کالبدشکافی یک قورباغه آویزان از قلابی برنجی بود. زمانی که او پای قورباغه را با چاقوی جراحی آهنی لمس کرد، پای قورباغه جمع شد. گالوانی عقیده داشت که انرژی جمع شدن، از خود پا به وجود آمد ولی همکار او، آلساندرو ولتا، عقیدهی دیگری داشت.
ولتا فرض کرد که حرکتهای پای قورباغه در اثر برخورد فلزهای متفاوت خیس شده در مایع است. او این آزمایش را به جای جسد قورباغه، با استفاده از یک لباس خیسانده شده در آبنمک تکرار کرد که منجر به نتایجی با ولتاژ مشابه شد. ولتا، یافتههای خود را در سال ۱۷۹۱ منتشر کرد و در سال ۱۸۰۰، اولین باتری را با عنوان پیل ولتایی (Voltaic pile) ساخت.

پیل ولتایی، شامل صفحههای روی و مس روی هم که به وسیله پارچه خیسانده شده در آبنمک از هم جدا شدهاند
پیل ولتایی، دو مشکل بزرگ داشت. اول این که وزن ناشی از صفحات روی هم باعث نشت الکترولیت از درون پارچه میشد. دوم این که خواص ویژه شیمیایی اجزای تشکیل دهنده، باعث طول عمر بسیار کوتاه باتری میشد (حدود ۱ ساعت). تا ۲۰۰ سال بعد، تحقیقات صرف بهبود عملکرد طراحی ولتا و رفع این مشکلات شد.
رفع مشکلات پیل ولتایی
ویلیام کرویکشانگ (William Cruickshank) اسکاتلندی، مشکل نشت را با قرار دادن پیل ولتایی به صورت «باتری افقی» حل کرد.
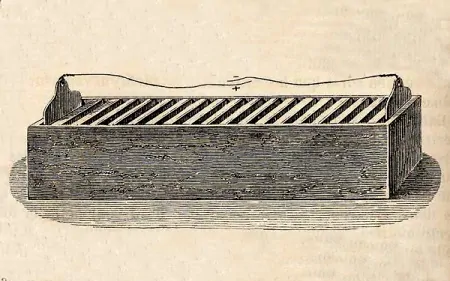
باتری افقی، مشکل نشت پیل ولتایی را حل کرد
مشکل دوم (طول عمر کوتاه)، ناشی از تخریب روی بر اثر وجود ناخالصیها و ایجاد حبابهای هیدروژن بر روی مس بود. در سال ۱۸۳۵ میلادی، ویلیام استورجن (William Sturgeon) کشف کرد که تقویت روی با جیوه، از تخریب آن جلوگیری میکند.
شیمیدان بریتانیایی، جان فردریک دانیل (John Frederic Daniell)، از یک الکترولیت ثانویه استفاده کرد. این الکترولیت، جهت جلوگیری از انباشته شدن هیدروژن بر روی کاتد مس، با آن واکنش میداد. باتری دو الکترولیتی دانیل، به عنوان سلول دانیل (Daniell cell) شناخته میشود. این باتری، محبوبیت زیادی در فراهم کردن انرژی شبکههای نوپای تلگراف داشت.
اولین باتری قابل شارژ
در سال ۱۸۵۹، فیزیکدان فرانسوی، گاستون پلانته (Gaston Planté)، با استفاده از دو ورق نورد شده سرب قرارگرفته در اسیدسولفوریک، یک باتری ساخت. با معکوس کردن جریان الکتریکی از طریق باطری، مواد شیمیایی به وضعیت قبلی خود باز میگشتند. این شروع اختراع اولین باتری قابل شارژ بود.
در سال ۱۸۸۱، کامیل آلفونس فوره (Camille Alphonse Faure)، عملکرد طراحی پلانته را با تبدیل ورقههای سرب به صفحات سرب بهبود بخشید. این طراحی جدید، تولید باتریها را آسانتر کرد. باتریهای سربی-اسیدی، کاربرد گستردهای در اوتوموبیلها پیدا کرد.

باتری خشک
تا اواخر سده ۱۸۰۰ میلادی، الکترولیت درون باتریها به صورت مایع بود. این مسئله، حملونقل باتریها را به یک کار بسیار محتاطانه تبدیل کرد. اکثر باتریها، به منظور جابجایی پس از اتصال به مدار ساخته نشده بودند.
در سال ۱۸۶۶، جورجز لکلانشه (Georges Leclanché)، با استفاده از آند روی، کاتد دیاکسید منگنز و محلول آمونیوم کلرید به عنوان الکترولیت، یک باتری ساخت. در حالی که الکترولیت درون سلول لکلانشه، مایع بود، ترکیبات شیمیایی باتری، قدم مهمی برای اختراع باتریهای خشک به حساب میآمد.
کارل گاسنر (Carl Gassner)، چگونگی ساخت یک الکترولیت با چسباندن آمونیوم کلرید و گچ پاریس را کشف کرد. او در سال ۱۸۸۶ در آلمان، حق امتیاز ساخت باتری با «سلول خشک» را دریافت کرد.
این سلولهای خشک که با عنوان «باتریهای روی-کربن» شناخته میشوند، به تولید انبوه رسیده و تا اواخر دهه ۱۹۵۰، به محبوبیت بالایی رسیدند. در حالی که در واکنش شیمیایی این باتریها از کربن استفاده نمیشد، نقش اساسی آن به عنوان یک رسانای الکتریکی است.

باتری روی-کربن سه ولتی، دهه ۱۹۶۰
در دهه ۱۹۵۰ میلادی، اعضای شرکت یونیون کارباید (Union Carbide)، لوییس اری (Lewis Urry)، پائول مارسال (Paul Marsal) و کارل کوردش (Karl Kordesch)، الکترولیت آمونیوم کلیرید را بر اساس فرمول شیمیایی باتری والدمار جانگنر (Waldemar Jungner)، با یک مادهی قلیایی یا اصطلاحاً آلکالین (alkaline) جایگزین کردند. باتریهای سلول خشک آلکالین، قابلیت نگهداشتن انرژی و عمر مفید بیشتری را نسبت به باتریهای روی-کربن در اندازه مشابه داشتند.
باتریهای آلکالین، در دهه ۱۹۶۰ بیشترین محبوبیت را پیدا کردند. این باتریها جایگزین باتریهای روی-کربن شده و به سلول اولیه استاندارد برای مصرفکنندگان تبدیل شدند.

باتریهای آلکالین در اندازه و شکلهای زیادی عرضه میشوند
باتریهای قابل شارژ قرن بیست
در دهه ۱۹۷۰، شرکت مخابراتی کامست (COMSAT)، باتری نیکل-هیدروژن را برای استفاده در ماهوارههای ارتباطی توسعه داد. این باتریها، هیدروژن را به شکل گاز فشرد شده در درون خود ذخیره میکنند. بسیاری از ماهوارههای دستساز، مانند ایستگاه فضایی بینالمللی، هنوز بر باتریهای نیکل-هیدروژن تکیه میکنند.
تحقیق بسیاری از شرکتها از اواخر دهه ۱۹۶۰، باعث ایجاد باتری نیکل– هیدرید فلز (NiMH) شد. باتریهای NiMH، در سال ۱۹۸۹ به مصرفکنندگان ارائه شدند. این باتریها، جایگزینی کوچکتر و ارزانتر از سلولهای قابل شارژ نیکل-هیدروژن را فراهم کردند.
شرکت تولیدکننده مواد شیمیایی آساهی (Asahi)، اولین باتری لیتیوم-یون را در سال ۱۹۸۵ تولید کرد. شرکت سونی (Sony)، اولین باتری لیتیوم-یون تجاری را در سال ۱۹۹۱ ساخت. در اواخر دهه ۱۹۹۰، یک محفظه نرم و قابلانعطاف، برای باتریهای لیتیوم-یون ساخته شد و باعث ظهور باتری «لیتیوم-پلیمر» یا «LiPo» شد.

اساس واکنش شیمیایی درون باتری لیتیوم-پلیمر مانند باتری لیتیوم-یون است
ترکیبات شیمیایی زیادی برای باتریها اختراع، تولید و در نهایت منسوخ شدند. در بخش دوم پست به معرفی اجزای تشکیلدهنده و نحوه عملکرد باتری پرداخته شده است.








